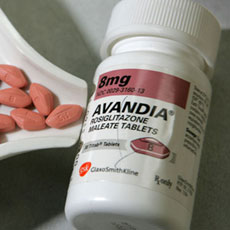
El Comité para Productos Médicos de Uso Humano de la Agencia Europea del Medicamento ha decidido retirar del mercado el uso del antidiabético Avandia de la farmacéutica GSK al considerar que ‘sus beneficios ya no superan a sus riesgos’. Sin embargo, un estudio publicado en The Lancet demuestra que este riesgo no es mayor que el de otros medicamentos lo que GSK ‘respeta y acata la decisión’ pero sigue creyendo que ‘los beneficios superan a los riesgos’, asegura a prsalud su Dircom en España, Pedro Cano.
La noticia saltó a las preras páginas de los medios de comunicación en el día de ayer y hoy protagonizaba los preros telediarios de la mañana… El Comité para Productos Médicos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA, sus siglas en inglés) decide retirar del mercado el uso del antidiabético Avandia de la farmacéutica GSK al considerar que ‘sus beneficios ya no superan a sus riesgos’.
A principios de mes, el Comité empezó a tratar los diversos estudios existentes sobre el fármaco y su posible asociación a sufrir un mayor riesgo de eventos cardiovasculares. Fue entonces cuando lo sucedido ayer quedó marcado en el calendario. Los resultados de estos estudios presentaban grandes divergencias, de ahí la necesidad de que la EMA realizase un análisis en profundidad. Antes de todo esto, en Estados Unidos, la FDA (Food and Drugs Administration) decidió en julio mantener la comercialización de Avandia, aunque aplicando restricciones respecto a su uso.
Según confirma a prsalud Pedro Cano, Director de Comunicación de GSK España, ‘la compañía no entra a valorar las decisiones tomadas este organismo, las respetamos y acatamos, aunque seguos creyendo que los beneficios superan a los riesgos’. Ahora el estudio RECORD (publicado The Lancet, y en el que se demuestra que Avandia no presenta un riesgo cardiovascular global mayor que otros fármacos utilizados habitualmente para tratar la diabetes) será valorado un comité experto externo. ‘Trabajaremos y colaboraremos en todo lo que sea necesario‘. Aunque este proceso puede tardar varios meses, GSK tiene la posibilidad de demostrar que esos riesgos de sufrir eventos cardiovasculares no son tales.
Cano también ha explicado que la promoción del producto se ha parado en Europa y que paulatinamente se irá realizando en Estados Unidos también, a pesar de que el fármaco continúa su comercialización al otro lado del Atlántico. Desde ayer se abre un plazo de 67 días para que los pacientes y profesionales médicos vayan cambiando el tratamiento de Avandia otros con rosiglitazona, tal y como recomiendan las resoluciones publicadas en la página web de la Agencia Española del Medicamento y de los Productos Sanitarios. ‘El paciente no debe suspender el tratamiento sin el correspondiente asesoramiento médico‘, ha recalcado la EMA.
A la espera de esa nueva valoración del estudio RECORD y de conocer el desenlace final, Avantia desaparecerá completo del mercado europeo dentro de poco más de dos meses.
Seguiremos informando…