GlaxoSmithKline plc e Innoviva, Inc. han anunciado los resultados positivos del ensayo clínico pivotal de fase III FULFIL, en el que se analiza la triple terapia cerrada combinada de una sola dosis diaria de furoato de fluticasona/umeclidinio/vilanterol (FF/UMEC/VI: una combinación inhalada de corticoesteroide, antagonista muscarínico de acción prolongada y beta-agonista de acción prolongada) en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
El estudio ha alcanzado sus dos variables principales, mostrando mejoras estadísticamente significativas en comparación con el tratamiento de dos veces al día con Symbicort® Turbohaler® (budesonida/formoterol 400/12mcg) tanto en la función pulmonar determinada mediante el VEF1 (171mL, intervalo de confianza del 95% [148, 194] p<0,001) como en la calidad de vida relacionada con la salud medida con el Cuestionario Respiratorio de St. George (CRSG) (-2,2 unidades, intervalo de confianza del 95% [-3,5, -1,0] p0,001), al terminar el período del estudio de 24 semanas. La proporción de pacientes que respondió con una diferencia mínima clínicamente importante en el CRSG (-4 unidades) fue del 50% con FF/UMEC/VI y del 41% con budesonida/formoterol.
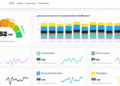
El perfil de seguridad de la triple terapia cerrada combinada tanto a las 24 semanas como a las 52 semanas en la fase de extensión, se corresponde con el perfil ya conocido de los fármacos administrados de forma individual o en combinación. A las 24 y a las 52 semanas los acontecimientos adversos más frecuentes en ambos grupos de tratamiento fueron rinofaringitis, cefalea y deterioro de la EPOC.
A las 24 semanas, la incidencia de acontecimientos adversos graves comunicados por el investigador fue del 5,4% y del 5,7% para FF/UMEC/VI y budesonida/formoterol respectivamente, de los cuales la incidencia del deterioro de la EPOC fue del 1,3% y del 2,3%; para la neumonía fue del 1,0% y del 0,3%, y para los trastornos cardíacos fue del 0,3% y del 1,0%, respectivamente.
A las 52 semanas, la incidencia de acontecimientos adversos graves comunicados por el investigador fue del 10,0% y del 12,7% para FF/UMEC/VI y budesonida/formoterol respectivamente, de los cuales la incidencia del deterioro de la EPOC fue del 2,4% y del 9,1%; para la neumonía fue del 1,9% y del 1,8%, y para los trastornos cardíacos fue del 1,4% y del 0,9%, respectivamente.
Dave Allen, Head of Respiratory R&D de GSK, ha comentado que “Estamos encantados con el resultado del estudio FULFIL, el cual supone un paso más hacia el objetivo de hacer llegar esta triple terapia cerrada combinada a los pacientes con EPOC apropiados. La triple terapia cerrada combinada ya es una realidad para muchos pacientes con EPOC y se dispensa a través de diversos inhaladores. Al combinar estos tres fármacos en un único inhalador, podemos ofrecer una cómoda opción de una única dosis diaria a los pacientes a la vez que se consigue una mejoría de sus síntomas”.
Mike Aguiar, CEO de Innoviva, afirmó que “Con el estudio FULFIL hemos demostrado unas mejoras significativas en la función pulmonar y en la calidad de vida relacionada con la salud al combinar tres fármacos para la EPOC en un único inhalador, comparado con la terapia dual de budesonida/formoterol. Si se aprueba, la triple combinación de una única dosis diaria será una importante incorporación a nuestra gama de productos respiratorios combinados en asociación con GSK, la cual incluye Relvar® Ellipta® y Anoro® Ellipta®”.
Los resultados del estudio FULFIL respaldan los planes de GSK de presentación el dossier de registro de la triple terapia cerrada combinada para la EPOC en la UE, la cual está prevista para finales de 2016. Tal como se anunció el 2 de junio de 2016, GSK también tiene previsto presentar una Solicitud de Nuevo Fármaco (New Drug Application, NDA por sus siglas en inglés) para la triple terapia cerrada combinada como tratamiento de la EPOC ante la Food and Drug Administration (FDA) de EE. UU. para finales de 2016.
El tratamiento triple cerrado es una combinación de tres fármacos: furoato de fluticasona (FF), un corticoesteroide inhalado (CI), umeclidinio (UMEC), un antagonista muscarínico de acción prolongada (LAMA) y vilanterol (VI), un agonista adrenérgico β2 de acción prolongada (LABA), administrados una vez al día en el inhalador Ellipta® de GSK. En el estudio FULFIL se comparan FF/UMEC/VI con budesonida y formoterol, una combinación de ICS/LABA administrada dos veces al día en el inhalador de polvo seco Turbohaler®. Los resultados completos del estudio FULFIL, incluidos los datos relativos a las variables de evaluación secundarias y al estudio de extensión de 52 semanas, se remitirán para su presentación en un congreso científico.