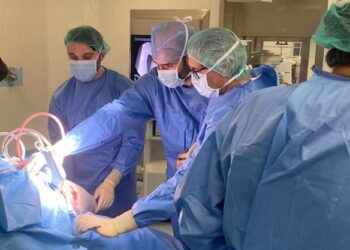
Novartis ha dado a conocer los resultados del prer ensayo pivotal de Fase III en estudiar un inhibidor de JAK 1/2 para el tratamiento de la policitemia vera (PV). Jakavi (ruxolitinib) mejoró significativamente el control del hematocrito sin la necesidad de una flebotomía (un procediento para extraer sangre del organismo a fin de reducir la concentración de glóbulos rojos2) y redujo el tamaño del bazo en los pacientes con PV con resistencia o intolerancia a la hidroxiurea1. Estos hallazgos se presentarán en el 50 Congreso Anual de la American Society of Clinical Oncology que se celebrará en Chicago, Estados Unidos.
La PV es una neoplasia sanguínea crónica incurable asociada a una producción excesiva de glóbulos rojos que puede provocar complicaciones cardiovasculares graves como los accidentes cerebrovasculares o los infartos de miocardio2. Actualmente se dispone de un número litado de tratamientos para la policitemia vera, lo que existe una tante necesidad no satisfecha de terapias que ofrezcan un control eficaz de la enfermedad.
‘Los tratamientos actuales no siempre logran controlar la enfermedad de los pacientes con policitemia vera, lo cual incrementa el riesgo de sufrir complicaciones cardiovasculares’, explicaba el Dr. Srdan Verstovsek, del MD Anderson Cancer Center, Houston, y principal autor del estudio. ‘En el ensayo clínico RESPONSE, los pacientes tratados con ruxolitinib mostraron un mejor control de la enfermedad, incluidos unos niveles de hematocrito bajo control sin la necesidad de realizar flebotomías, una reducción del tamaño del bazo y un mejor manejo de los síntomas en comparación con las terapias actuales’.
En la semana 32 del ensayo, el 77% de los pacientes aleatorizados a ruxolitinib alcanzaron uno o los dos objetivos prarios: del control del hematocrito (centaje del volumen de glóbulos rojos en toda la sangre) o una reducción del tamaño del bazo en comparación con el 20% de los pacientes aleatorizados a la mejor terapia disponible. Un número significativamente superior de pacientes lograron uno o los dos objetivos prarios con el tratamiento de ruxolitinib, en comparación con la mejor terapia disponible (21% en comparación con el 1%, respectivamente; p< 0,0001), y el 91% de estos sujetos tratados con ruxolitinib mantuvieron su respuesta en la semana 481.
‘Hay una tante necesidad de nuevos tratamientos para la policitemia vera, ya que se trata de una enfermedad que presenta síntomas debilitantes diarios tan graves como los asociados con la mielofibrosis y supone un tante riesgo de que los pacientes sufran complicaciones cardiovasculares graves, como los accidentes cerebrovasculares o los infartos de miocardio’, declaraba el Dr. Alessandro Riva, MD, Presidente interino de Novartis Oncology y Director Internacional de Desarrollo Oncológico y Asuntos Médicos.
‘Estos hallazgos refuerzan los significativos beneficios clínicos de ruxolitinib y su potencial para convertirse en una tante opción terapéutica para los pacientes con policitemia vera que ya no responden o presenten intolerancia a los tratamientos anteriores’.
En el ensayo, el 49% de los pacientes tratados con ruxolitinib mostraron una mejora mína del 50% en los síntomas relacionados con la PV, en comparación con el 5% de los pacientes que recibieron la mejor terapia disponible1. Los pacientes que recibieron ruxolitinib experentaron además una reducción en la sudoración nocturna y el picor (de alrededor del 99% y el 95%, respectivamente)4. Además, una mayor proción de pacientes del grupo de tratamiento con ruxolitinib logró una respuesta hematológica completa según la definición de los criterios modificados de la European LeukemiaNet (ELN) de 2009, un objetivo secundario clave, en comparación con el brazo que recibió la mejor terapia disponible (24% en comparación con el 9%, respectivamente; p= 0,003)1.
Ruxolitinib se toleró bien, y los acontecientos adversos (AA) se correspondieron con los vistos anteriormente en los ensayos de ruxolitinib en la PV y la mielofibrosis1,5,6. Durante las prera 32 semanas de tratamiento, los AA hematológicos de Grado 3 o 4 en el brazo de ruxolitinib fueron la anemia (1,8%) y la trombocitopenia (5,5%), y un número inferior de pacientes tratados con ruxolitinib experentaron acontecientos tromboembólicos en comparación con los que recibieron la mejor terapia disponible (1 paciente en comparación con 6, respectivamente). Los acontecientos adversos no hematológicos más comunes fueron los dolores de cabeza, la diarrea y el cansancio, y fueron en su mayoría de Grado 1 o 21. Además, el 3,6% de los pacientes aleatorizados al grupo de ruxolitinib interrumpieron el tratamiento debido a los AA, en comparación con el 1,8% del grupo de la mejor terapia disponible.
Los datos del ensayo RESPONSE avalarán las solicitudes regulatorias previstas para este año en todo el mundo y se presentarán en el 19 Congreso de la Sociedad Europea de Hematología en que se celebrará en Milán, Italia. Ruxolitinib está autorizado actualmente en más de 60 países para el tratamiento de pacientes con mielofibrosis, una neoplasia sanguínea debilitante y potencialmente mortal.
Diseño del ensayo
RESPONSE es un ensayo internacional, aleatorizado llevado a cabo en 109 centros. 222 pacientes con PV resistentes o intolerantes a la hidroxiurea fueron aleatorizados 1:1 a ruxolitinib (dosis inicial de 10 mg dos veces al día) o a la mejor terapia disponible, que fue definida como la monoterapia elegida el investigador o únicamente la observación. La dosis de ruxolitinib se ajustó según las necesidades a lo largo del ensayo.
El objetivo prario del ensayo fue el centaje de pacientes cuyo hematocrito se controló sin necesidad de realizar una flebotomía desde la semana 8 a la 32, y cuyo volumen del bazo se redujo un 35% como míno en relación a los niveles basales según un diagnóstico agen a las 32 semanas. Además, la eficacia se evaluó mediante dos objetivos secundarios clave: la respuesta praria duradera y la remisión hematológica completa. Otros objetivos fueron la seguridad, la mejora de los síntomas (según la evaluación total de síntomas de 14 elementos MPNSAF) y la calidad de vida.