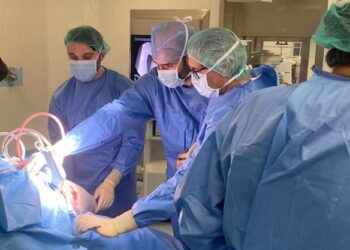
Sanofi ha anunciado que la Administración de Medicamentos y Alentos de EE. UU. (FDA) ha aceptado la solicitud de registro (New Drug Application, NDA) de Toujeo® (insulina glargina [origen ADNr] inyectable, 300 U/ml), una insulina basal en fase de investigación. Dicha aceptación de la solicitud de registro ha tenido lugar tras la aceptación del dosier para la autorización de comercialización de Toujeo parte de la Agencia Europea de Medicamentos (EMA) para los países de la UE el 27 de mayo de 2014.
La solicitud de registro de Toujeo se basa en los resultados del programa de ensayos clínicos EDITION, que consiste en una serie de estudios Fase III exhaustivos e internacionales que evalúan la eficacia y seguridad de Toujeo en más de 3500 personas procedentes de amplias y variadas poblaciones con diabetes.
Toujeo es el nombre comercial de insulina glargina [origen ADNr] inyectable, 300 U/ml, a la que antes se conocía con la abreviatura “U300”. En la actualidad, U300 no está aprobado ni autorizado en ningún lugar del mundo.