Gedeon Richter anuncia que el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) ha dado su opinión positiva a la solicitud de la compañía de ampliar la indicación de Esmya® (Acetato de Ulipristal 5 mg comprimidos) como tratamiento intermitente repetido de los síntomas moderados y graves de los miomas uterinos.
La opinión positiva del CHMP se reenviará a la Comisión Europea, quien esperamos que amplíe la autorización de comercialización de Esmya® 5 mg en Europa, con aplicación en todos los países de la Unión Europea, en el trascurso de los próximos dos meses desde la emisión de dicha opinión positiva.
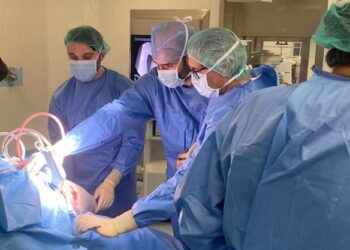
La autorización inicial de Esmya® 5 mg comprimidos fue otorgada para el tratamiento preoperatorio de los síntomas moderados y graves de los miomas uterinos en mujeres adultas en edad reproductiva. La extensión de la indicación incluyendo el tratamiento intermitente repetido va a proporcionar, una vez obtenida la aprobación final, la posibilidad de ver controlados los síntomas producidos por los miomas uterinos a muchas mujeres que sufren de esta patología sin límite de tiempo pudiendo evitar en algunos casos la cirugía.
La solicitud de la ampliación de la indicación de Esmya® 5 mg se ha basado en los resultados del estudio PEARL IV, que valoraba y ha confirmado la eficacia y seguridad del tratamiento intermitente y repetido a largo plazo con Acetato de Ulipristal 5 mg y 10 mg en pacientes con miomas uterinos y sangrado abundante.