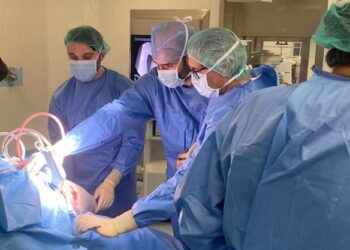
Novartis ha anunciado hoy que The New England Journal of Medicine (NEJM) ha publicado datos de PKC412 (midostaurin) que demuestran una tasa de respuesta global, definida como una respuesta total o parcial, del 60% (intervalo de confianza [IC] 95%, 49-70%; P<0,001) en pacientes con mastocitosis sistémica (MS) avanzada. La mediana de duración de la respuesta para todos los que respondieron en la población de eficacia primaria fue de 24,1 meses (IC 95%, 10,8-no estimado [NE]).
La MS avanzada es una enfermedad rara que se caracteriza por la acumulación de mastocitos anormales, un tipo de glóbulo blanco, en médula ósea, hígado, bazo y otros órganos, que provoca daño orgánico. También se caracteriza por la activación frecuente de mutaciones del gen KIT5. Los pacientes con MS avanzada tienen mal pronóstico; la supervivencia global oscila entre menos de 6 meses a 3,5 años, según el subtipo, y actualmente no hay ningún tratamiento aprobado para la mayoría de los pacientes.
El estudio clínico de Fase II CPKC412D2201 ha sido el ensayo prospectivo más largo y extenso realizado sobre este raro trastorno. Jason Gotlib, médico de la Stanford University School of Medicine y el Stanford Cancer Institute, participó como investigador principal del estudio, que reclutó a 116 personas con MS avanzada. Un comité de dirección del estudio se encargó de supervisar la idoneidad y las respuestas y 89 pacientes fueron seleccionados para la población de eficacia primaria. Los pacientes recibieron PKC412 (midostaurin) oral en monoterapia hasta la progresión de la enfermedad o toxicidad inaceptable. Los resultados demostraron una mediana de la supervivencia global (SG) de 28,7 meses (IC 95%, 18,1-NE). Se detectaron mejoras en la carga mastocítica de la médula ósea y los niveles de triptasa en suero (un marcador de la carga mastocítica) en el 78% de los pacientes, y se asociaron a una regresión de la enfermedad.
“Estos datos muestran una clara mejoría de la enfermedad y los síntomas con el tratamiento oral con midostaurin en participantes del estudio que reflejan la heterogeneidad de la enfermedad”, anunció el Profesor Andreas Reiter, del Departamento de Hematología y Oncología del Hospital Universitario Mannheim de la Universidad de Heidelberg, Alemania y autor principal del estudio. “Si se aprueba, midostaurin les ofrecerá a los pacientes una opción de tratamiento muy necesaria”.
Los efectos secundarios más frecuentes fueron gastrointestinales. A excepción de las náuseas y vómitos, los 32 síntomas declarados en la Escala de Evaluación de Síntomas del Memorial disminuyeron significativamente con el tratamiento (P<0,001). La calidad de vida, evaluada con la versión reducida de 12 preguntas del Cuestionario de Salud (SF-12), también aumentó significativamente con el tratamiento con PKC412 (midostaurin), comparado con los valores en valor basal: la mejora se manifestó en un aumento del 26% (P<0,001) de la puntuación en salud mental y del 29% (P0,001) de la puntuación de salud física.
“Los pacientes con MS avanzada forman parte de una comunidad muy pequeña y desatendida que ha padecido la ausencia de innovación médica durante muchos años”, explicó Alessandro Riva, médico y Director Global del Departamento de Oncología y Asuntos Médicos de Novartis. “Novartis está orgulloso de haber desarrollado un tratamiento que muestra beneficios para dichos pacientes y ahora está trabajando con las autoridades regulatorias para que midostaurin esté disponible lo antes posible”.
Los resultados del estudio de Fase II también se han visto reforzados en una carta publicada en el mismo del NEJM por el French Reference Centre of Mastocytosis (CEREMAST) acerca de un programa de uso compasivo de PKC412 (midostaurin) en MS avanzada. Tras una mediana de tiempo de seguimiento de 18,5 (3-36) meses, la tasa de respuesta global al tratamiento fue del 71%. Tras un tiempo de seguimiento similar, la tasa de supervivencia global (SG) fue del 42,7%, comparada con el 14,9% en un grupo de control histórico comparado (P=0,03). También se observó un riesgo dos veces mayor de muerte en el grupo de control (HR 2,2; P=0,02). Los efectos secundarios más frecuentes fueron náuseas y vómitos en el 89% de los pacientes (que provocaron abandono del tratamiento en el 18%), linfopenia en el 61% sin infecciones oportunistas y fotosensibilidad en el 25%. Los autores llegaron a la conclusión de que PKC412 (midostaurin) es eficaz en MS avanzada6.
PKC412 (midostaurin) es un inhibidor de quinasas en investigación, oral y multidiana que recibió recientemente la designación de terapia innovadora para adultos con leucemia mieloide aguda (LMA) con mutación de FLT3 recién diagnosticada de la US Food and Drug Administration (FDA). Además, PKC412 (midostaurin) posee designación de fármaco huérfano en la UE y EE.UU. para LMA y mastocitosis.
Dado que PKC412 (midostaurin) se encuentra en investigación en este momento, Novartis abrió un Programa Global de Pacientes Individuales (programa de uso compasivo) para permitirle el acceso a PKC412 (midostaurin) a pacientes pediátricos y adultos con mastocitosis sistémica agresiva (MSA), leucemia mastocítica (LM) o sarcoma mastocítico (SM). Los médicos que deseen solicitar PKC412 (midostaurin) para pacientes aptos deberían ponerse en contacto con un representante médico de Novartis de sus respectivos países. En EE.UU., los pacientes pueden llamar al 1-888-NOW-NOVA (1-888-669-6682) para más información.