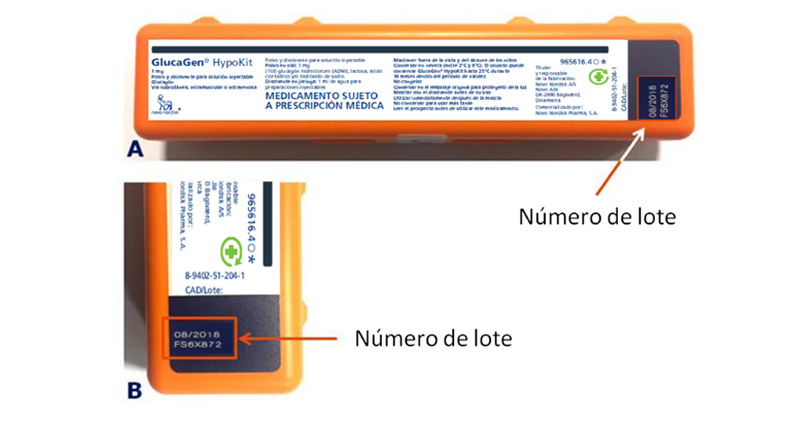
¿Te imaginas que perdieras la consciencia y presentaras convulsiones debido a un nivel ínfimo de azúcar en la sangre y que el único medicamento que puede salvarte la vida, o al menos evitar que entre en coma, no funcionara correctamente por un defecto que ha pasado desapercibido para el laboratorio? Pues a esta peligrosa situación han estado expuestos los pacientes con diabetes que, con la precavida intención de controlar a tiempo una hipoglucemia grave que pudiera afectarle, se preocuparon de adquirir en su farmacia una unidad del GlucaGen Hypokit de Novo Nordisk sellado con el número de lote FS6X872. ¿Ha pedido disculpas el laboratorio o ha buscado la forma de compensar a los pacientes que hayan sufrido daños en su salud debido a este defecto?
Pues por ahora no. A través de una carta informativa remitida a las asociaciones de pacientes con diabetes, el director de CMR de la sede española de Novo Nordisk Pharma, Francisco José Pajuelo, ha explicado los procedimientos a seguir tanto para reconocer las unidades de producto afectadas como para hacerlo llegar al laboratorio. “Novo Nordisk realizó una investigación en la que se detectó un reducido número de agujas desprendidas de la jeringa en algunos lotes de GlucaGen HypoKit. A fin de proteger la seguridad de los pacientes, Novo Nordisk ha iniciado la retirada del lote afectado en España a nivel de mayoristas, farmacias y pacientes”, explica.
De pedir disculpas a los pacientes que han estados expuestos a tremendo riesgo y anteponer factores tan importantes para la fidelización de los mismos a la marca y para la reputación de la compañía como la calidad en las relaciones humanas y el trato justo, no hay ni sombra. Así, no es de extrañar que el laboratorio, y en concreto el departamento de Comunicación que dirige la periodista Silvia Muñoz desde hace cerca de ocho años, esté viendo cómo se tambalea uno de los pilares básicos para la supervivencia de cualquier compañía: su imagen. ¿Estamos ante una crisis de Comunicación muy mal gestionada?
Agujas que se desprenden, motivo de máxima alerta para la Aemps
Alerta farmacéutica de clase 1. Con el máximo nivel de riesgo para la comunicación de incidencias de calidad en los medicamentos de uso humano ha catalogado la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) el peligro que supone para las personas con diabetes de nuestro país el hecho de suministrarse cualquier unidad de GlucaGen® HypoKit procedente del lote FS6X872, un producto que se emplea en pacientes diabéticos dependientes de insulina que experimentan una reacción hipoglicémica grave, es decir, un desmayo debido a un nivel ínfimo de azúcar en la sangre.
¿El motivo? La Aemps detectó la “posibilidad de que la aguja se desprenda en un número bajo de jeringas, lo que impediría su uso”. Este defecto detectado en el lote FS6X872 del producto fabricado por laboratorio danés Novo Nordisk, cuya fecha de caducidad señalada es agosto de 2018, “impediría su uso” en caso de producirse una hipoglucemia. De ahí que el organismo que dirige Belén Crespo haya ordenado la retirada del mercado de todas las unidades distribuidas y haya pedido a las comunidades autónomas que hagan un seguimiento de dicha retirada y su devolución al laboratorio.
¿Qué debe hacerse en caso de tener un envase de GlucaGen® HypoKit?
El fármaco GlucaGen Hypokit contiene el principio activo glucagón hidrocloruro en dosis de un miligramo en polvo y disolvente para la solución inyectable, e incluye un vial y una jeringa precargada de disolvente. En caso de estar en posesión de un envase de GlucaGen® HypoKit con el número de lote mencionado, el paciente debe dirigirse a su farmacia y entregarlo. En su lugar se le entregará de manera gratuita una unidad de GlucaGen® HypoKit sin defecto.
Francisco José Pajuelo llama a la calma en caso de estar en posesión de un envase de GlucaGen® HypoKit que no corresponde al número de lote antes mencionado. “Puede tener la certeza de que el producto funcionará según lo prescrito”, asegura el director de CMR de Novo Nordisk.
Seguiremos informando…