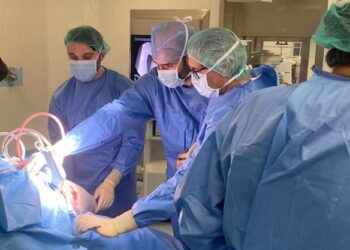
Novartis Oncology ha presentado RYDAPT® (midostaurina), un inhibidor oral de múltiples quinasas incluyendo FLT3 y KIT, siendo la primera terapia dirigida aprobada en España para pacientes con LMA de nuevo diagnóstico con mutación FLT3 candidatos a quimioterapia intensiva y la única terapia para los tres tipos de MS avanzada, dos tipos de enfermedades hematológicas malignas y con pocas opciones de tratamiento hasta la fecha, y cuyos pacientes tienen una esperanza de vida muy limitada. Se trata, además, de la primera novedad para el tratamiento de este tipo de LMA en los últimos 25 años.
En concreto, RYDAPT® (midostaurina), ha sido incluido en la financiación del Sistema Nacional de Salud de nuestro país para tratar a pacientes adultos con LMA de nuevo diagnóstico con mutación FLT3, en combinación con quimioterapia de inducción estándar (daunorubicina y citarabina), y de consolidación (altas dosis de citarabina).
Asimismo, se ha aprobado como monoterapia para el tratamiento de pacientes adultos con mastocitosis sistémica agresiva (MSA), mastocitosis sistémica con neoplasia hematológica asociada (MS-NHA) o leucemia de mastocitos (LM).
Hoy hacemos llegar a los pacientes una gran innovación terapéutica, RYDAPT® (midostaurina), para dos tipos de enfermedades muy difíciles de tratar hasta la fecha. Nos encontramos ante una excelente noticia para unos pacientes con importantes necesidades no cubiertas y para quienes seguiremos trabajando más allá del descubrimiento de nuevas terapias”, ha afirmado José Marcilla, director general de Novartis Oncology en España.
RYDAPT® (midostaurina) primera terapia para LMA con mutación FLT3
Con entre 5 y 8 casos anuales por cada 100.000 habitantes, la LMA es una enfermedad rara que representa el 25% de las leucemias en todo el mundo y alrededor de un tercio de todos los casos nuevos de leucemia. Además, es la forma más común de leucemia aguda entre adultos, y causa el mayor número de muertes anuales por leucemia (40%).
A pesar de que existe una clara necesidad de nuevos tratamientos para la LMA con terapias dirigidas que mejoren los resultados ofrecidos por la quimioterapia, para el Dr. Miguel Ángel Sanz, coordinador del Área de Investigación de Oncología y Hematología del Instituto de Investigación Sanitaria La Fe de Valencia y coordinador del Grupo PETHEMA, “nos encontramos en un momento fascinante, ya que estamos entrando en una nueva era del tratamiento de esta enfermedad, marcada por el conocimiento de las alteraciones genéticas que tienen las células de la leucemia”.
Este conocimiento de las alteraciones genéticas ha permitido, según el mismo doctor, “hacer enormes progresos en búsqueda de formas alternativas muy interesantes y exitosas, como es el caso de RYDAPT® (midostaurina), que es altamente eficiente en los pacientes con mutación FLT3”. Una mutación presente en un tercio de los pacientes con LMA.
La autorización de esta terapia dirigida para la LMA se ha basado en los datos del ensayo RATIFY, desarrollado en colaboración con la Alliance for Clinical Trials in Oncology y 13 grupos colaborativos internacionales6, entre los que se incluyen dos grupos españoles (PETHEMA y CETLAM).
Este ensayo ha evaluado la eficacia y seguridad de RYDAPT® (midostaurina) en combinación con quimioterapia estándar frente a placebo más quimioterapia estándar y como monoterapia de mantenimiento. La variable principal fue la supervivencia global y el análisis se realizó tras un seguimiento mínimo de aproximadamente 3,5 años. Así, se ha demostrado una reducción del 22% en el riesgo de muerte con RYDAPT® (midostaurina) más quimioterapia estándar en comparación con placebo más quimioterapia estándar6. La mediana de la supervivencia global ha sido de 74,7 meses y 25,6 meses, respectivamente.
En este sentido, el Dr. Jorge Sierra, presidente de la Sociedad Española de Hematología y Hemoterapia y jefe del Servicio de Hematología del Hospital Universitario de la Santa Creu i Sant Pau, afirmó: “Para los pacientes de LMA, la aprobación de RYDAPT® (midostaurina) supone una mejora de su pronóstico en términos de menos recaídas y mayor supervivencia, además de potenciar el efecto del trasplante a partir de un donante si se realiza en primera remisión completa”.
Cabe destacar, asimismo, que no solo se ha demostrado una supervivencia significativamente mejor, sino también una excelente tolerabilidad “dado que la adición de RYDAPT® (midostaurina) al tratamiento no ha supuesto una toxicidad destacable”, ha determinado el Dr. Sierra. Tanto es así que “en comparación con el grupo de pacientes al que se le administró placebo, no hubo diferencias estadísticamente significativas en lo que a efectos secundarios se refiere”, ha corroborado el Dr. Sanz.
Única terapia aprobada para MS avanzada en la UE
En términos generales, la mastocitosis pertenece a las denominadas enfermedades raras o poco frecuentes, que vienen definidas porque afectan a menos de 1 de cada 2.000 habitantes, “aunque algunos estudios epidemiológicos han sugerido una prevalencia entre 5 y 10 veces menor en el caso de la mastocitosis”, afirmó el Dr. Iván Álvarez Twose, coordinador del Instituto de Estudios de Mastocitosis de Castilla La Mancha – CSUR de Mastocitosis.
En lo que respecta a las formas avanzadas de la enfermedad, este mismo doctor explicó que “representan alrededor del 9-12% de todas las mastocitosis, pero dado que son patologías cuyo diagnóstico a menudo es complejo, muy probablemente este tipo de mastocitosis esté infradiagnosticada”. En la MS avanzada el desarrollo incontrolado de mastocitos neoplásicos provoca daños orgánicos, alteración de los recuentos sanguíneos y pérdida de peso. Dicha proliferación incontrolada de mastocitos se debe en la mayoría de los pacientes a una mutación del gen c-kit.
Según ha indicado el Dr. Álvarez Twose, en el Instituto de Estudios de Mastocitosis de Castilla-La Mancha (CLMast), único Centro de Referencia (CSUR) de mastocitosis que existe en España y al que son derivados pacientes de todo el país, “se diagnostican alrededor de 150 nuevos casos de mastocitosis cada año, lo que supone un total de prácticamente 2.000 pacientes a fecha de hoy, de los cuales menos de 100 pertenecen al grupo de MS avanzada”.
Al igual que ocurre con la LMA, los pacientes con MS avanzada tenían opciones de tratamiento muy limitadas, por lo que la llegada de RYDAPT® (midostaurina) supone un importante avance. De hecho, se trata de la primera y única terapia aprobada tanto por la FDA americana como por la Agencia Europea del Medicamento para tratar este tipo de enfermedad hematológica.
“Todo ello indica que por fin disponemos de un fármaco con capacidad real de modificar el curso clínico desfavorable y mejorar significativamente el pronóstico y la esperanza de vida de los pacientes con MS avanzada”, ratificó el Dr. Álvarez Twose.
En este caso, su aprobación se ha basado en dos ensayos multicéntricos abiertos de un solo brazo, incluyendo el estudio de Fase II CPKC412D2201, el mayor ensayo prospectivo realizado en esta rara enfermedad, cuyos resultados también se publicaron en NEJM.
La eficacia de RYDAPT® (midostaurina) se estableció utilizando los criterios de respuesta de Valent modificados, demostrando una tasa de respuesta global, definida como una respuesta mayor o parcial, del 59,6%. La eficacia también se evaluó en un análisis post-hoc usando los criterios de consenso del International Working Group-Myeloproliferative Neoplasms Research and Treatment-European Competence Network on Mastocytosis y estimó una tasa de respuesta global del 28,3%.