Novartis ha anunciado hoy que la Food and Drug Administration (FDA) de EE. UU. ha aprobado Beovu® (brolucizumab) en inyecciones, también conocido como RTH258, para tratar la degeneración macular asociada a la edad (DMAE) húmeda. Beovu es el primer anti-VEGF aprobado por la FDA que ofrece mayor resolución de fluido respecto a aflibercept y la capacidad de mantener a los pacientes con DMAE húmeda elegibles/aptos en un intervalo de tratamientode tres meses inmediatamente después de la fase de carga de tres meses1 sin comprometer la eficacia.
“Beovu cumple nuestros objetivos en la práctica clínica para tratar la DMAE húmeda: mejorando la visión y secando el fluido retiniano”, apuntó el Dr. Pravin U. Dugel, socio director de Retinal Consultants of Arizona; profesor clínico del Roski Eye Institute, la Facultad de Medicina Keck de la Universidad del Sur de California; e investigador principal del ensayo clínico HAWK. “Con Beovu, una mayor reducción de fluido se demostró a través de mayores reducciones del grosor de la retina y una mayor proporción de pacientes con la retina seca. Junto con su potencial para tratar a pacientes con inyecciones trimestrales, esta aprobación podría cambiar el modo en que enfocamos el tratamiento de la DMAE húmeda”.
La aprobación de Beovu se ha basado en los hallazgos de los ensayos clínicos de Fase III HAWK y HARRIER, en los que Beovu demostró su no inferioridad frente a aflibercept en el cambio medio de la mejor agudeza visual corregida (MAVC) a un año (semana 48). En ambos ensayos clínicos, alrededor del 30% de los pacientes ganaron al menos 15 letras en el primer año. En HAWK y HARRIER, Beovu demostró una mayor reducción del grosor del subcampo central (GSC) ya en la semana 16 y a un año y menos pacientes tuvieron fluido intrarretiniano (FIR) y/o fluido subrretiniano (FSR). El fluido retiniano es un marcador clave de la actividad de la enfermedad.
La DMAE húmeda es una enfermedad ocular degenerativa crónica causada por un exceso de VEGF, una proteína que promueve el crecimiento de vasos sanguíneos anómalos debajo la mácula, la zona de la retina responsable de la visión aguda central. El fluido que se filtra de estos vasos sanguíneos anómalos perturba la estructura normal de la retina y finalmente provoca daños en la mácula8-10. La molécula de Beovu se ha diseñado para ofrecer la mayor concentración del fármaco, ofreciendo más agentes vinculantes activos que otros anti-VEGFs2. Al inihibir VEGF, Beovu suprime el crecimiento de los vasos sanguíneos anómalos y la posibilidad de que haya exudación de fluido en la retina”.
“La aprobación de Beovu confirma el compromiso de Novartis de reimaginar los tratamientos para los pacientes que sufren deterioro visual grave”, afirmó Marie-France Tschudin, presidente de Novartis Pharmaceuticals. “Las fichas de producto de los tratamientos existentes indican que no son tan eficaces cuando se administran cada 12 semanas. Beovu ha sido el primero en ofrecer una dosificación menos frecuente en el primer año de terapia manteniendo su eficacia. Esto les da más tiempo a los pacientes con DMAE húmeda para centrarse en las cosas importantes de la vida”.
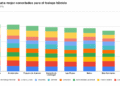
En HAWK y HARRIER, los pacientes elegibles podían mantenerse en intervalos de tratamiento de tres meses tras la fase de carga. A un año, más de la mitad de los pacientes se habían mantenido en intervalos de tratamiento de tres meses (56% en HAWK y 51% en HARRIER). Los demás pacientes del estudio se trataban cada dos meses.
Beovu mostró un perfil de seguridad global comparable al de aflibercept. Beovu está contraindicado en pacientes con infecciones oculares o perioculares, inflamación intraocular activa o con hipersensibilidad conocida a brolucizumab o a cualquiera de los excipientes de Beovu. Las reacciones de hipersensibilidad pueden manifestarse como sarpullido, prurito, urticaria, eritema o inflamación intraocular grave.
Los acontecimientos adversos más frecuentes (≥5% de los pacientes) con Beovu fueron visión borrosa, cataratas, hemorragia conjuntival, flotadores del vítreo y dolor ocular.
La DMAE húmeda distorsiona la visión central y finalmente causa ceguera y pérdida de independencia. Las estimaciones sugieren que 1,75 millones de personas en EE. UU. padecerán DMAE húmeda en 202013-15, y será un problema de salud pública cada vez mayor. Los primeros síntomas de DMAE húmeda incluyen visión borrosa o vacilante8. A medida que la enfermedad avanza, los pacientes pierden visión central, por lo que les resulta difícil ver los objetos que tienen justo delante.
“Cuando una persona pierde visión, también pierde conexión con el mundo”, explicó Dawn Prall, fundador y director ejecutivo de la Fundación Support Sight. “Le damos la bienvenida a un nuevo tratamiento que ayuda a mantener la visión y ofrece la posibilidad de tratamientos trimestrales, capaces de reducir la carga de pacientes y cuidadores y ayudar a la gente con DMAE húmeda a seguir haciendo lo que les gusta con sus seres queridos”.
Con esta aprobación, Novartis ofrece BEOVU Your Way® en EE. UU. Este programa ofrece apoyo personalizado individual a pacientes y cuidadores, con acceso a un especialista sanitario dedicado a entender las necesidades y preferencias únicas de cada paciente. Novartis se enorgullece de colaborar con organizaciones de defensa del paciente para ofrecer material educativo a pacientes y cuidadores, con el fin de empoderar a los pacientes con DMAE húmeda para que vivan de forma segura e independiente.
Seguiremos Informando…