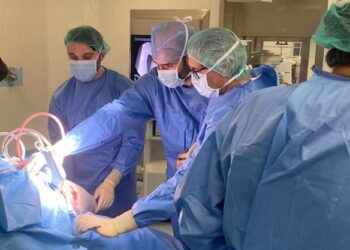
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), dependiente del Ministerio de Ciencia e Innovación, aprueba el ensayo clínico en fase II de la vacuna española contra la COVID-19, según anuncia el presidente del Gobierno, Pedro Sánchez.
El Gobierno destinará 15 millones de euros, ya aprobados en el Consejo de Ministros, a este proceso en el que participarán 1.000 voluntarios en 10 centros sanitarios de toda España. Así lo ha explicado Sánchez durante la presentación del segundo Proyecto Estratégico de Colaboración Público-Privada (PERTE).
La compañía farmacéutica Hipra pasa al ensayo 2-3, que significa que se amplían las pruebas a más población. Mientras que la fase 2 comprende un número limitado de voluntarios para valorar su eficacia en humanos, la 3 suma a más personas para lograr una muestra significativa.
Ya son tres los hospitales del Servicio Madrileño de Salud (SERMAS) que han lanzado la oferta: La Paz, Gregorio Marañón y Príncipe de Asturias (Alcalá de Henares). Los candidatos deben ser mayores de 18 años y haber recibido la vacuna Comirnaty de Pfizer-BioNTech contra la COVID-19 como mínimo hace seis meses.
La vacuna HIPRA está desarrollada íntegramente en España. En la primera fase, realizada a finales de agosto, se realizaron pruebas en más de 400 voluntarios a través de un ensayo de doble ciego. Esto significa que ni los pacientes ni los investigadores sabían qué producto ha recibido cada uno ni la dosis exacta.
A principios del año 2022 es el plazo que se marca Sanidad para comenzar a comercializar esta vacuna española contra la COVID-19. Y es que, la empresa española HIPRA prevé producir 400 millones de dosis de su vacuna COVID-19 durante ese mismo año.
+ de 21 AÑOS diciendo
Seguiremos informando…