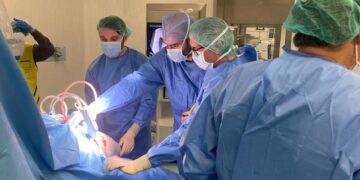
Una propuesta de terapia génica para la anemia de Blackfan Diamond ha sido designada como medicamento huérfano por la Agencia Europea del Medicamento (EMA). Este medicamento consiste en las propias células madre de la sangre de los pacientes a las que se ha insertado mediante un vector lentiviral el gen RPS19, que aparece alterado en el 25 por ciento de las personas que sufren esta enfermedad rara.
Esta nueva propuesta de terapia génica ha sido coordinada por los doctores Susana Navarro y Juan Bueren, de la Unidad de Innovación Biomédica en el Centro de Investigaciones Energéticas, Medioambientales y Tecnológicas (CIEMAT), el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) y el Instituto de Investigación Sanitaria de la Fundación Jiménez Díaz (IIS-FJD). Este equipo ya ha desarrollado otros medicamentos huérfanos similares, con los que se están realizando novedosos ensayos clínicos para otra anemia congénita -la anemia de Fanconi- y también otras enfermedades hematológicas raras.
La anemia de Blackfan Diamond es un síndrome hereditario de fallo de médula ósea que se caracteriza principalmente por carencia de glóbulos rojos, anomalías congénitas y un elevado riesgo de desarrollar determinados tipos de cáncer. Se trata de una enfermedad rara con una incidencia de siete casos por millón de personas. Está provocada por mutaciones en alguno de los 20 genes que pueden causarla, aunque las mutaciones en RPS19 son las más habituales.
En la actualidad, el único tratamiento curativo para los pacientes con esta enfermedad es el trasplante de células madre sanguíneas de un donante sano compatible, que tan solo existe para algunos pacientes. El resto de los tratamientos de soporte tienen importantes limitaciones en su eficacia o efectos secundarios que disminuyen la calidad de vida de los pacientes.
La propuesta de terapia génica para la anemia de Blackfan Diamond que acaba de ser designada medicamento huérfano se realiza ex vivo. Con los ensayos preclínicos realizados, se ha conseguido corregir en el laboratorio el defecto genético de células madre hematopoyéticas de estos pacientes mediante la inserción de la versión correcta del gen RPS19 a través de un vector lentiviral. El próximo paso será comenzar los ensayos clínicos basados en la reinfunsión de las células madre corregidas en los pacientes.
La designación europea de este medicamento huérfano está promovida por CIBERER, junto con el CIEMAT y el IIS-FJD. En su desarrollo, han participado también los investigadores Yari Giménez y Manuel Palacios, de la Unidad de Investigación Biomédica del CIEMAT/CIBERER/IIS-FJD, y diferentes grupos clínicos. Los estudios desarrollados han sido posible gracias a diferentes colaboraciones, entre las que destaca la financiación de un proyecto del CIBERER y otro del European Joint Programme on Rare Diseases (EJPRD) del H2020.
El CIBERER, promotor de 14 medicamentos huérfanos
Con esta nueva designación, el CIBERER ha promovido ya 14 medicamentos huérfanos designados por la EMA, cuatro de los cuales también han sido designados como tales por la agencia americana (FDA).
Seis de estos medicamentos corresponden a terapia génica y los otros ocho son reposicionamientos, es decir, fármacos que ya se utilizan para otras patologías que están siendo evaluados para su uso en alguna enfermedad rara.
La designación como medicamento huérfano por parte de la EMA tiene ventajas como la de recibir una autorización de comercialización durante diez años, en los que no pueden comercializarse productos similares. También disponer de protocolos de asistencia y consejo científico gratuitos o con un coste reducido, además de la exención de pagos para la designación. Finalmente, las entidades que desarrollan medicamentos huérfanos tienen acceso a subvenciones específicas de la Unión Europea y de los programas de los estados miembros.
+ de 21 AÑOS diciendo
Seguiremos Informando…